我所创新药物研究中心关于肿瘤蛋白酶靶向智能PET分子探针研究获得新成果
近日,我所创新药物研究中心林建国研究员、邱玲研究员团队在化学类顶级期刊、中科院1区Top期刊《美国化学会志》(Journal of the American Chemical Society, JACS)(IF=15.419)上在线发表研究论文。该研究报道了一种全新的分子自组装骨架体系,通过加以不同靶向基团的修饰,使其能够对肿瘤微环境中不同蛋白酶特异性识别、响应乃至自组装聚集,从而使探针检测信号强度大大增强。利用此信号放大策略可有效解决小分子及多肽类探针代谢清除快、靶点滞留效果差的关键科学问题,为灵敏特异地检测低浓度下特定蛋白酶的含量和活性提供了强有力的工具。
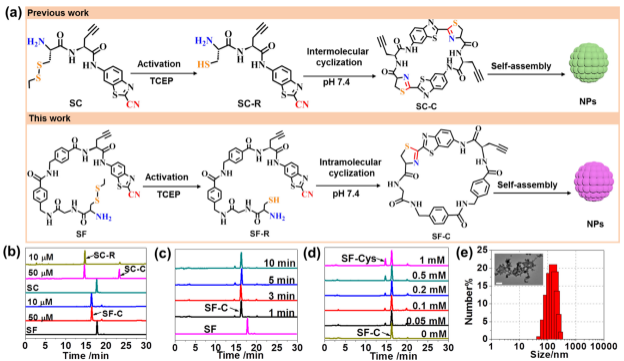
利用活体细胞中发生的生物正交反应将小分子自组装成超分子是药物开发的新兴领域。研究人员基于2-氰基苯并噻唑与半胱氨酸(CBT-Cys)的点击缩合反应,在CBT和Cys之间引入两个对氨基苯甲酸基团,增强了肽链的刚性和疏水性,有助于促进分子内环化,并增强骨架的稳定性;引入甘氨酸基团可以调节形成环的大小,有利于提高探针分子内缩合环化的速率。在生理条件下,自组装骨架SF能在1 min内快速转化为分子内缩合产物,且在低浓度时仍能有效缩合成环,受游离半胱氨酸的影响大大降低,为靶向修饰的探针酶控自组装形成超分子带来了极大的优势。
分子自组装骨架体系的构建
在验证了骨架SF能够快速地发生分子内缩合反应后,研究人员将肿瘤凋亡蛋白酶caspase-3特异性识别的底物DEVD连接到SF骨架,设计开发了一种PET显像探针[18F]SF-DEVD,用于阿霉素治疗后宫颈癌HeLa凋亡水平的PET显像检测。结果显示,注射探针[18F]SF-DEVD 15分钟后,经阿霉素治疗后发生凋亡的肿瘤部位显像清晰,放射活性最高达到7.74 ± 1.56 %ID/mL,而在没有经过阿霉素治疗的荷瘤鼠中肿瘤部位未见有明显的放射性摄取。此外,共注射少量的冷化合物SF-DEVD后,探针在阿霉素治疗后的HeLa肿瘤部位摄取最高可达10.29 ± 1.11 %ID/mL,并具有良好的滞留效果,60分钟时肿瘤部位仍清晰可见,肿瘤/肌肉摄取比最高达到了6.91 ± 0.66。这些结果表明,借助新型骨架SF的优良特性,探针[18F]SF-DEVD在PET显像监测化疗药物诱导肿瘤凋亡蛋白酶caspase-3活性方面具有巨大的应用潜力。
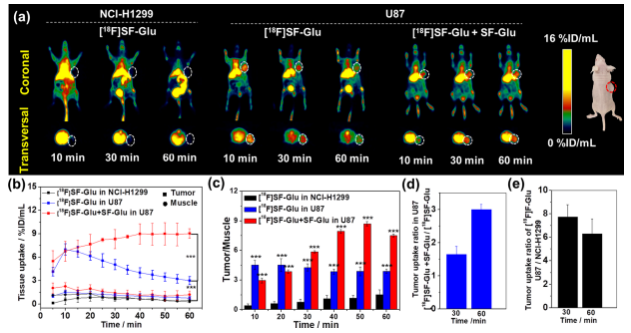
为了进一步验证该骨架的适用性,研究人员将γ-谷氨酰转肽酶(GGT)特异性识别的底物γ-谷氨酸连接到SF骨架,设计开发了另一种PET显像探针[18F]SF-Glu,用于肿瘤微环境中GGT酶活性的PET显像。注射探针[18F]SF-Glu 10分钟后,即可在GGT高表达的神经胶质瘤U87荷瘤鼠中观察到肿瘤部位具有明显的放射性浓聚,最高达到了6.98 ± 0.72 %ID/mL,而在GGT低表达的非小细胞肺腺癌NCI-H1299荷瘤鼠的肿瘤部位未观察到明显的放射性信号。同时冷化合物共注射策略可以有效提高探针[18F]SF-Glu在肿瘤中的浓聚,并延长滞留时间,60分钟时探针在肿瘤中的摄取仍然达到9.03 ± 0.64%ID/mL,而肿瘤/肌肉摄取比也高达7.51 ± 0.14。这些结果表明,利用骨架SF连接γ-谷氨酸可以开发出GGT酶靶向特异性PET分子探针,实现活体中GGT活性的灵敏特异检测。
该研究为肿瘤微环境中蛋白酶靶向响应型诊断和治疗药物的研发提供了一种新的研究思路和技术平台,为发展新一代灵敏度高、特异性强的PET分子探针临床研究奠定了坚实的基础。
肿瘤谷氨酰转肽酶靶向PET分子探针在肿瘤诊断中的应用
该论文的第一作者为林建国研究员,通讯作者为林建国研究员、邱玲研究员。高顶耀、王世杰、吕高超、王秀婷、陆春梅和彭莹等也对论文工作做出了重要贡献。
Jianguo Lin*, Dingyao Gao, Shijie Wang, Gaochao Lv, Xiuting Wang, Chunmei Lu, Ying Peng and Ling Qiu*. A stimuli-responsive macrocyclization scaffold allows in situ self-assembly of radioactive tracers for positron emission tomography imaging of enzyme activity. Journal of the American Chemical Society, doi:10.1021/jacs.1c12935.
 栏目导航
栏目导航